浏览次数:5 发布时间:2026-01-30 09:52:27
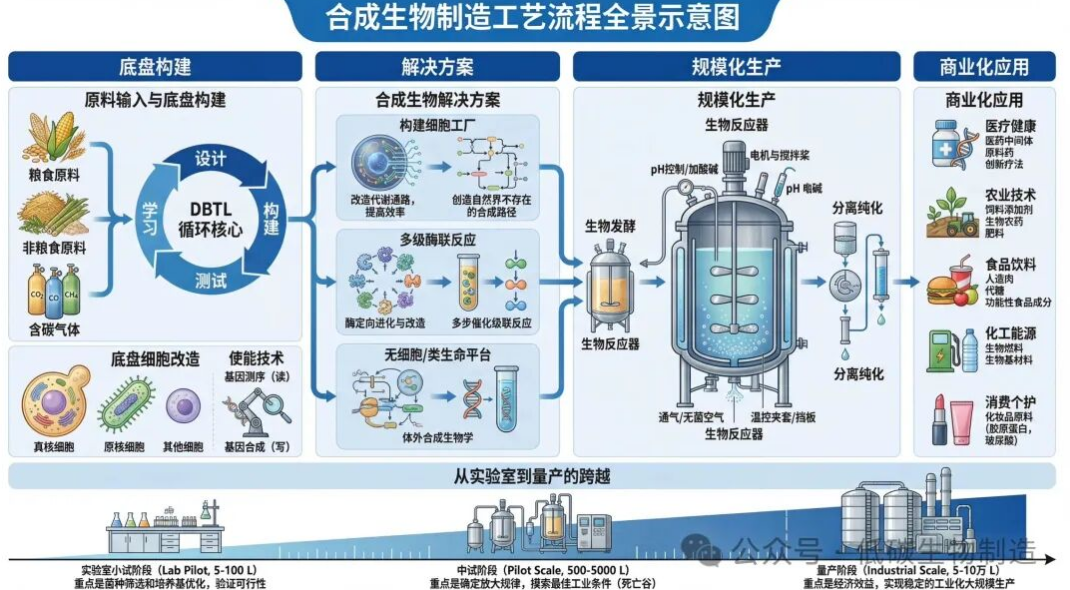
本示意图以清晰、系统的视觉语言,全景式地展示了合成生物学从最基础的物质与设计起点,直至最终商业化产品的完整技术链条与产业逻辑。整体流程遵循“设计-构建-测试-学习”(DBTL)的循环内核,从左至右依次展开,可分为四个核心层次:底盘构建、解决方案、规模化生产与商业化应用,底部则描绘了贯穿始终的 “从实验室到量产” 的产业化放大之路。以下将分层次进行详实描述。
第一层次:底盘构建——生命系统的“原料”与“基石”
这是整个合成生物制造的起点,决定了制造过程的根本原材料和进行改造的生命载体。该板块分为上下两部分,明确了“输入什么”和“用什么造”。
1. 原料输入:多元化碳源战略
示意图顶端明确列出了三类初始原料,体现了合成生物制造在原料端摆脱传统粮食依赖、追求可持续性的核心思想:
-
-
粮食原料:如玉米、甘蔗等富含糖类的传统生物发酵原料。其优势在于成分明确、技术成熟,但存在“与人争粮、与粮争地”的伦理与资源争议。
-
-
非粮食原料:包括秸秆、木屑等木质纤维素类生物质。这是第二代生物制造的关键原料,来源广泛、成本低廉,但预处理和糖化技术复杂,是当前研发重点。
-
-
含碳气体:主要指一氧化碳(CO)、二氧化碳(CO₂)、工业废气等。利用微生物(如梭菌、氢氧化细菌)直接固定气体合成目标产物,代表了最具颠覆性的第三代生物制造路线,既能实现碳减排,又能将废气变废为宝,是长远发展的方向。
2. 底盘细胞改造:设计生命的工具箱
原料输入下方,聚焦于改造对象——底盘细胞及其改造工具。
-
-
细胞类型:示意图涵盖了从原核细胞(如大肠杆菌、谷氨酸棒杆菌,结构简单、易于遗传操作、生长迅速)到真核细胞(如酵母、丝状真菌,具有蛋白质翻译后修饰能力,适合生产复杂蛋白),乃至其他细胞(可能包括植物细胞、哺乳动物细胞等)。选择何种底盘,取决于目标产物的性质、生产工艺复杂度及成本。
-
-
使能技术:这是驱动底盘改造的“读写”工具。
-
-
基因测序(“读”):快速、低成本地解析各类生物(包括极端环境微生物)的基因组蓝图,为挖掘有价值的基因元件、理解代谢通路提供海量数据基础。
-
-
基因合成(“写”):根据设计,化学合成或组装所需的DNA片段、基因乃至整个基因组,是实现“设计生命”从概念到实体的关键物理步骤。
-
-
DBTL循环核心:位于该板块中心,设计(Design)-构建(Build)-测试(Test)-学习(Learn) 的循环是贯穿合成生物学研究与开发的方法论灵魂。在此阶段,它特指在底盘构建中:设计代谢路径与基因回路;构建重组DNA并导入底盘细胞;测试改造后细胞的性能;学习测试数据以优化下一轮设计。此循环迭代往复,直至获得性能达标的工程菌种。
第二层次:解决方案——实现合成的三种技术路径
获得基础底盘后,需要选择具体的技术路径来实现目标分子的合成。示意图展示了三种主流且互补的解决方案,它们根据产品特性、技术成熟度和经济性进行选择。
1. 构建细胞工厂
这是最经典、应用最广泛的路径。其核心是对活体底盘细胞进行彻底的代谢工程改造。
-
-
原理:通过基因编辑工具(如CRISPR),对细胞固有的代谢网络进行“删、改、增”,优化物质流和能量流,将碳源高效导向目标产物。例如,提高前体供应、敲除竞争途径、强化输出通路等。
-
-
目标:一是提高天然产物的生产效率(如提高酵母生产青蒿酸的产量);二是创造自然界不存在的全新合成路径,生产稀有或非天然化合物(如吗啡前体、新型生物塑料单体等)。
-
-
特点:依赖细胞的自我复制与代谢能力,适合大规模、低成本生产大宗化学品和材料。但细胞复杂的内部环境可能带来副产物多、代谢负担重等问题。
2. 多级酶联反应
当细胞工厂路径因细胞毒性或代谢过于复杂而受限时,此路径提供了更精细化的解决方案。其核心是在体外(in vitro)重构代谢通路。
-
-
原理:不依赖完整细胞,而是从不同生物中提取或通过工程菌表达所需的多个酶,将其纯化后,在优化的反应体系中按顺序组装,形成一个多步催化的级联反应。
-
-
关键:依赖于酶的定向进化与改造,以提高每个酶的活性、稳定性和特异性,并确保不同酶之间的反应条件(如pH、温度)兼容。
-
-
优点:反应路径清晰、副产物少、产物易分离、无需考虑细胞存活,尤其适用于合成具有多个手性中心的高价值精细化学品(如某些药物中间体)。但酶的成本较高,大规模制备和固定化技术是关键。
-
3. 无细胞平台
这是最具前沿性的路径,试图在最大程度简化生命系统的同时,保留其核心合成能力。
-
-
体外合成生物学:利用无细胞蛋白质合成系统(如从大肠杆菌提取的转录-翻译机器),直接以DNA或mRNA为模板,在试管中合成蛋白质。这彻底摆脱了细胞膜的限制和复杂的调控网络,是快速原型设计、生产有毒蛋白或病毒样颗粒的理想平台。
-
- 特点:高度模块化、可控,是基础研究和特种产品制备的强大工具,但距离大规模工业化生产仍有距离。
第三层次:规模化生产——从“毫升”到“万升”的工程飞跃
此阶段是将实验室验证的合成方案,转化为稳定、经济的实物产品的核心制造环节。示意图以生物反应器为核心,清晰地分为上游发酵和下游分离纯化两部分。
1. 生物发酵过程(上游加工)
在巨型不锈钢发酵罐(生物反应器)中进行。示意图标注了反应器的关键控制参数,这直接决定了细胞工厂的性能:
-
-
物理条件:温度、pH、搅拌速率(影响溶氧和混合均匀度)、压力。
-
-
化学条件:溶氧(DO)(对好氧发酵至关重要)、补料策略(流加碳源、氮源等以维持高生产率)。
-
-
生物状态:通过在线传感器监测细胞生物量、产物浓度等。
-
-
过程:在严格受控的条件下,接种的工程菌株利用输入原料(糖、气体等)进行生长和代谢,将碳流大规模转化为目标产物。这个过程充满了工程挑战,涉及传质、传热、流场、反应动力学等多学科交叉。
2. 分离纯化(下游加工)
发酵结束后,得到的是含有目标产物、细胞、培养基组分、副产物的复杂混合物。下游加工的目的是高效、高纯度地获取产物,其步骤通常包括:
-
-
固液分离:通过离心或过滤移除菌体。
-
-
初步提取:可能包括破碎细胞(若产物在胞内)、萃取、沉淀等。
-
-
精细纯化:采用层析(色谱)等技术,根据分子大小、电荷、疏水性等差异,将目标产物与其他杂质分离。
-
-
成品化:浓缩、结晶、干燥,得到符合规格的最终产品(如粉末、晶体、液体)。
-
下游加工的成本常占生产过程总成本的50%以上,是决定整体经济性的关键。
第四层次:商业化应用——赋能千行百业的终端价值
示意图最右侧展示了合成生物制造广阔的应用前景,其产品正渗透至国民经济和日常生活的各个方面:
-
-
医疗健康:革命性药物(如mRNA疫苗、抗体、CAR-T细胞治疗)、精准营养(母乳低聚糖HMO、稀有益生菌)、诊断材料(高纯度酶、荧光蛋白)。
-
-
农业技术:生物农药与肥料(工程微生物菌剂)、动植物疫苗、饲料添加剂(氨基酸、维生素)、作物性状改良(合成生物学助力育种)。
-
-
食品饮料:功能性成分(甜蛋白、稀有人参皂苷)、发酵食品(人造肉、奶酪)、食品添加剂(香兰素、色素)。
-
-
化工能源:生物基材料(可降解塑料PLA/PHA、尼龙单体)、生物燃料(生物乙醇、航空煤油)、平台化学品(丁二酸、1,3-丙二醇)。
-
-
消费个护:化妆品活性成分(角鲨烯、胶原蛋白)、香料和香精(玫瑰精油、广藿香醇)、环保洗涤用酶。
底层贯穿:从实验室到量产的跨越——必经的产业“死亡谷”
示意图底部清晰地勾勒出了从概念到商品的必经之路,揭示了产业化过程中的核心挑战与阶段目标。
1. 实验室小试阶段(5-100L)
-
-
核心目标:验证科学可行性,侧重于菌种/酶的性能优化和培养基/反应体系的初步摸索。
-
-
重点:在摇瓶和台式发酵罐中,通过DBTL循环快速迭代,获得高产、稳定的“种子选手”。此阶段主要解决“能否合成”的问题。
-
2. 中试阶段(100-5000L)
-
-
核心目标:验证工程与工艺可行性,是连接实验室与工厂的“桥梁”,常被称为“死亡谷”。
-
-
重点:确定放大规律。在更大的反应器中,传质、传热、剪切力等物理因素发生剧变,必须通过中试摸索最佳的工业控制参数(如搅拌、通气、补料曲线),并建立稳定、可重复的工艺操作规程。同时,进行初步的成本核算和经济性评估。此阶段解决“能否放大、是否经济”的问题。
-
3. 量产阶段(5-10万L)
-
-
核心目标:实现经济效益最大化下的稳定、连续、大规模生产。
-
-
重点:成本控制、生产稳定性、产品质量一致性。需要建立完整的质量管理体系、供应链和废弃物处理方案。任何微小的工艺波动都将导致巨大的经济损失,因此过程的自动化控制、在线监测和故障预警至关重要。此阶段最终解决“能否盈利、能否占领市场”的问题。
-
总结
这幅全景图不仅是一个静态的技术流程图,更动态地揭示了合成生物制造的内在逻辑:它以DBTL循环为方法论核心,以多元化原料和工程化底盘为基础,提供了从活体细胞到无细胞系统的多路径解决方案,并通过严苛的规模化工程放大,最终将“设计生命”的能力转化为赋能各行各业的实际产品。底部跨越“死亡谷”的产业化路径则警示我们,从一篇顶级论文到一个成功的商品之间,横亘着漫长而艰巨的工程化、商业化征程。这张图精准地捕捉了合成生物学作为“平台型”颠覆技术,从实验室走向产业、从单点突破走向系统集成的宏伟画卷。